Iron (Fe) selective extraction - 土壤中鐵的選擇性抽出方法
2021/07/19
在研究土壤的路上,鐵的選擇性抽出是常見到的方法,各個實驗室應該都有自己傳承下來的劑量、樣品量,但總是要追本溯源到最原始的論文來參考,不然白白的引用了文獻卻不知道原文內容又有何用。因此選在即將進行碩士論文的選擇性抽出實驗之際,細心的研究一下常見的選擇性抽出方法原理以及其來源。
這篇文章圍繞在土壤最常探討的三種化育產生的鐵 (pedogenic iron) - 分別為游離鐵Fed、無定型鐵Feo以及與有機物錯合的鐵Fep,通常在測定這些萃取法時也會一同測定鋁的濃度,是為Ald、Alo及Alp,但是在方法上這種劃分其實是針對鐵的,所以鋁的參考價值會比較低一點。
再補充,這些萃取方法充其量只是操作性定義,並非完全神聖專一的區隔不同相態的鐵,不要將這裡的分類作為至高無上的定律,僅可奠基於其化學原理做一定程度的解釋,切勿過度解釋數據。
We are what we repeatedly do. Excellence, then, is not an act, but a habit.
—Will Durant
游離鐵Fed - dithionite-citrate-bicarbonate (DCB) 萃取法
最常引用的是Mehra and Jackson (1960),所謂的游離鐵指的是在土壤中獨立於原生礦物 (矽酸鹽礦物) 外存在的鐵氧化物,只要不在原生礦物的晶格中,便屬於游離鐵,這些鐵氧化物主要為含鐵的礦物,例如赤鐵礦 (hematite)、針鐵礦 (goethite)、纖鐵礦 (lepidocrocite) 以及水合鐵礦 (ferrihydrite),其中赤鐵礦與針鐵礦是最主要的兩種鐵礦物。在土壤中常見的鐵礦物主要含有的是Fe3+,除了磁鐵礦 (magnetite) 也含有Fe2+。
土壤在風化過程中,鐵會經過礦物的風化過程而釋出,在土壤中氧化形成鐵氧化物也就是游離鐵,這些鐵氧化物有的具良好結晶,有的則結晶不良好。鐵氧化物可以做為土壤中的膠結劑,把土壤顆粒聚集在一起,所以在進行物理性分析如粒徑分析時,去除鐵氧化物可以測得更精準的粒徑。化學性質方面,鐵氧化物的帶電性與pH值有關,屬於土壤中的可變電荷,游離鐵影響土壤中的許多物理化學性質,因此測定游離鐵的方式相當重要。
萃取游離鐵的方法是使用還原劑將鐵氧化物還原成水溶性的Fe2+,而困在矽酸鹽礦物晶格內的鐵便不會被萃取出來,還原後的土壤會失去鐵氧化物的紅棕色,轉變成灰白色 (石英等矽酸鹽的顏色),顏色變化非常美麗,推薦剛開始學習土壤的人一定要操作這個實驗。
游離鐵的萃取劑稱作DCB,DCB是三種藥劑的縮寫:
- Dithionite:Na2S2O4,作為還原劑,S2O42-能將Fe3+還原成Fe2+。但要注意的是在溫度超過80°C後S2O42-會自行分解成S2O32-與HSO3-,因此不能讓溫度超過80°C以上。
- Citrate:是很好的chelating agent,可以與溶液中的Fe2+錯合,避免與硫發生沉澱。
- Bicarbonate:NaHCO3,作為緩衝溶液,維持溶液的pH值約為7。
整個DCB的萃取過程是一個還原反應,sodium dithionite是一個常見的還原劑,在有機化學上也會用到,在自身氧化的過程中會消耗4個OH-而還原氧化鐵,而且這個氧化過程的氧化電位與環境的pH值有關。
在實驗環境中pH值極為重要,因為 (1) 在酸性環境下Fe2+能與硫形成FeS沉澱故須使pH值提升,(2) 為了最佳化鐵還原的效率必須提高pH值以提高S2O42-的氧化電位 (使其更傾向氧化,進而還原Fe3+),以及 (3) 氧化時消耗OH-必須補充否則反應難以持續進行。
因此Mehra and Jackson (1960) 提出的就是以bicarbonate穩定pH值、提高氧化電位並提供OH-。實驗結果證實以bicarbonate作為緩衝溶液的效果極佳,不僅讓氧化電位提高,穩定的緩衝能力也讓pH值不變動 (另外測試的NaOH反而使pH值容易變動),並提供足夠的OH-,且其提供的緩衝pH = 7.3也讓FeS不易沉澱,故常使用這三種藥劑組合的DCB法。
原文實驗流程
- 使用4 g soil + 40 mL 0.3 M Na-citrate + 5 mL 1 M Na-bicarbonate (C:B = 8:1),置於100 mL管
- 以80°水浴加熱並加入1 g Na-dithionite (但要注意各水浴槽溫度,不要過熱)
- 持續攪拌1分鐘後放置15分鐘 (中途攪拌)
- 15分鐘結束後加入10 mL飽和食鹽水 (促進土壤分散,使離心效果較好)
- 離心5分鐘1600-2000 rpm,後續溶液過濾稀釋上機
對於此方法有些重點與修正,考慮到有些熱帶地區的土壤氧化鐵過多 (例如極育土),會將將樣品用量改為1 g,反應至土色變白。若5分鐘無法離心完整,有時使用20分鐘3500 rpm。
有關樣品均質性的問題:在Soil Science Society of America出版的方法書中提到了樣品均質性的問題,並建議將土樣過250 mesh篩網,這在原作中是沒有特別提到的。而磨土的費工以及能磨過這麼細篩網的土能否代表原本的土樣,端看個人取捨,10 mesh也能產出很好的數據。
藥品配置
0.3 M Na-citrate:88.23 g Na-citrate (含兩分子水,分子量294.1) 溶於1000 mL水
1 M Na-bicarbonate:84 g Na-bicarbonate (分子量84) 溶於1000 mL水 (溶解時加熱會比較好溶)
無定型鐵Feo - acid ammonium oxalate (酸性草酸銨) 萃取法
要注意這個名詞中文是稱作無定型鐵,要注意不要打錯字。
前面提到,游離鐵又可分為結晶性良好以及不好的鐵礦物,而這兩種在土壤中所造成的影響也是不同的,結晶性較差者就被稱作無定型 (amorphous) 鐵礦物。
無定型鐵生成的原因有三種,分別為 (1) 環境潮溼生成的纖鐵礦或水合鐵礦 (2) 火山岩漿快速冷卻所生成的玻璃物質例如鋁英石 (allophane) 和絲狀鋁英石 (imogolite) 或是 (3) 與有機質錯合的鐵,其中 (1) 與 (2) 合起來可被稱為短程有序 (short-range-order, SRO) 鐵礦物,代表他們雖然有結構但並不連續。無定型鐵礦物具有較大的比表面積,化學反應性質較結晶性的鐵要來的活潑,又被稱作活性鐵 (active iron),故測定無定型鐵含量是相當重要的。為了得知土壤中無定型鐵的含量,使用的方法是pH = 3,0.2 M酸性草酸銨 (NH4)2C2O4 萃取法。
最常被引用的文獻是Mckeague and Day (1966),該研究測試了許多不同種類土壤、不同pH值、不同萃取時間的效果。酸性草酸銨萃取並不像DCB方法是將可還原的鐵萃取出,因此這個萃取是動力學控制 (kinetically controlled),也就是說反應的條件至關重要,不同反應條件下萃取出的量也會不同,故切勿過度解釋數據。不同的鐵氧化物 (甚至矽酸鹽礦物) 都會跟酸性草酸銨反應,但剛好的酸度使得最主要萃取的是無定型鐵。
- 溶液pH值:以pH = 3最適合,過高的萃取效果不好,過低則怕矽酸鹽礦物溶出。
- 萃取時間:在萃取一小時後仍有無定型鐵溶出,選用4小時的連續萃取。
在進行草酸銨萃取時,必須將其置於黑暗中,因為長期照光會導致草酸根分解,儲存樣品也要用不透光的瓶子或是在外層包鋁箔紙。由於溶液的pH值很重要,若土壤中有碳酸鹽類必須先去除以免影響。
原文實驗流程
- 使用125或250 mg soil + 10 mL 0.2 M ammonium oxalate (pH = 3),置於15 mL管
- 在黑暗中震盪4小時
- 取出,過濾稀釋上機
常修改土與藥劑的比例成1 g:50 mL。在震盪完後可加入5滴的0.2% Superfloc溶液促進絮聚,使用10 min 3000 rpm離心後過濾。
值得注意的是,原文便提到了萃取的效率與土壤磨碎程度有關,因此建議使用100 mesh的土,但實際操作上也是看個人取捨。
藥品配置
有很多種方法,只要配置出pH = 3的0.2 M草酸銨即可,草酸銨其實是由更早的Schwertmann (1964) 所提出。
- 0.2 M 草酸銨:28.42 g草酸銨 (含一分子水,分子量142.11) 溶於1000 mL水
- 0.2 M 草酸:25.21 g草酸 (含兩分子水,分子量126.07) 溶於1000 mL水
之後將草酸銨與草酸以1:0.75混合,其pH值將接近目標的3,再使用鹽酸/氨水來調整至pH = 3。來自Schwertmann (1964) 以及俄亥俄州立大學的SOP則是以700 mL:535 mL這樣更精細的比例混合。
另一法 (來自Soil Science Society of America出版的方法書) 是將24.87 g草酸銨 (含一分子水) 與12.61 g草酸 (含兩分子水) 一同加入約800 mL水中,並用氨水或鹽酸調整到pH = 3後定量至1000 mL。
有機錯合態Fep - sodium pyrophosphate (焦磷酸) 萃取法
常引用的論文是Loveland and Digby (1984),有機錯合態的鐵就如同名字所示,是與土壤中的有機物錯合在一起的鐵,是無定型鐵中的一部分,很常用來評估在淋澱土 (Spodosols) 裡的淋澱化物質 (spodic material),淋澱化物質會隨著淋洗往下移動並累積在土壤B層,進而形成淋澱層 (spodic horizon)。與有機質錯合的鐵又和氧化鐵礦物有著不同的性質,因此評估土壤中的含量也是很重要的。
這個萃取方法多是使用0.1 M焦磷酸 (pyrophosphate) 的鉀鹽或是鈉鹽組合,最常使用的是Na-pyrophosphate。與無定型鐵的萃取相同,這個方法的萃取量也取決於過程中的環境條件,離心條件更是影響很大,所以這個方法並不完全等同於有機錯合態的鐵,一樣的切勿過度解釋數據。
0.1 M焦磷酸鈉 (Na4P2O7) 的原本pH值為9.6,Loveland and Day (1984) 測試了調整不同pH值及後續離心處理方法 (有趣的是,在論文內將比較的三種方法稱之為英國法、美國農部法與加拿大法”Canadian technique”,後來最穩定的是加拿大法),研究中選用不同條件能萃取出的量有所不同,但是因為並沒有標準品可以做驗證,並不能說萃取最多或最少的比較好,研究總結是應該選用具分析一致性 (原文:analytically consistent) 的方法,因此如下的條件便被沿用至今。
原文實驗流程
- 使用1 g soil + 100 mL 0.1 M Na-pyrophosphate (pH = 10) 置於125 mL管
- 室溫震盪16小時
- 加入數滴0.1% Superfloc溶液
- 以1500 rpm離心10分鐘後,過濾稀釋上機
土與樣品比例不變,研究中的美國農部法使用0.4% Superfloc,並以2000 rpm離心直到澄清,我實際使用1500 rpm是離心不完全的。
在Loveland and Day (1984) 的研究中使用的粒徑是< 0.5 mm (35 mesh),但是在Soil Science Society of America出版的方法書則是使用< 2 mm (10 mesh) 即可。
藥品配置
0.1 M 焦磷酸鈉:將44.61 g Na-pyrophosphate (10水合,分子量446.06) 溶於約800 mL水中,並使用NaOH調整至pH = 10後定量至1000 mL (理論上pH是9.6,但我實際配出來pH超過10,只好用鹽酸調回來)。
總結
這三種萃取法都是常見的實驗,務必搞懂他們的限制與應用,然後不要把這三種定義當作神聖的,而只是操作性的劃分,最重要的是奠基於萃取的化學性質作出解釋即可。由於萃取劑的強弱與化學上的劃分,理論上Fed包含Feo與Fep,而Feo包含Fep,如下圖。
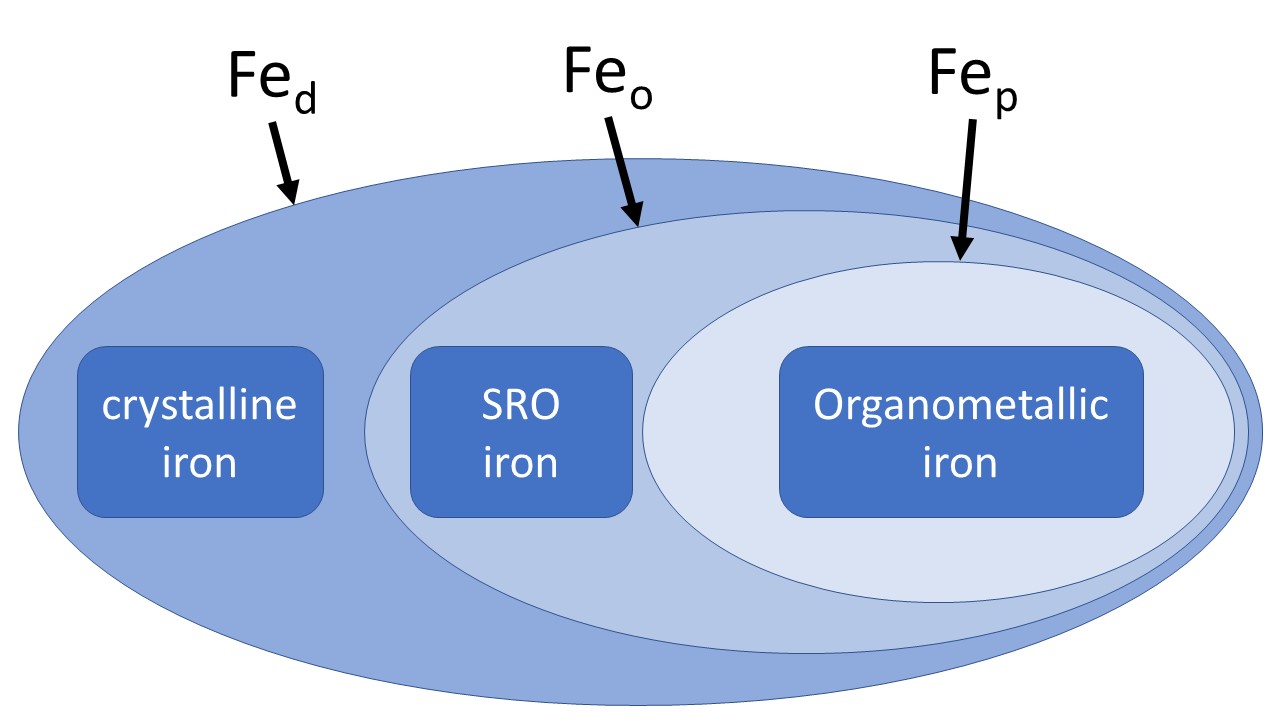
但有些有機錯合物太多或是無定型物質太多的土壤中,也會有差異,有時也會測到有機態鐵高於無定型鐵的數據。實際利用上,(Fed - Feo)/Fed可以做為鐵結晶程度的指標,而Alo + 0.5Feo則可作為淋澱土的分類依據之一。
另外本文常提到的Soil Science Society of America出版的方法書指的是Methods of Soil Analysis, Part 3: Chemical Methods,我們實驗室內有常備一本,照著這本書基本上不會出錯,鐵的部分是Loeppert and Inskeep (1996),裡面也有簡介原理,非常實用。
參考文獻
Loeppert, R., and Inskeep, W. 1996. Iron. In D.L. Sparks, A.L. Page, P.A. Helmke, R.H. Loeppert, P.N. Soltanpour, M.A. Tabatabai, C.T. Johnston, and M.E. Sumner (Eds.). Methods of Soil Analysis: Part 3 Chemical Methods (pp. 639–664). Madison, WI: Soil Science Society of America. https://doi.org/10.2136/sssabookser5.3.c23
Loveland, P.J., and Digby, P. 1984. The extraction of Fe and Al by 0.1 M pyrophosphate solutions: a comparison of some techniques. Journal of Soil Science, 35(2), 243-250. https://doi.org/10.1111/j.1365-2389.1984.tb00280.x
McKeague, J., and Day, J. 1966. Dithionite-and oxalate-extractable Fe and Al as aids in differentiating various classes of soils. Canadian journal of soil science, 46(1), 13-22. https://doi.org/10.4141/cjss66-003
Mehra, O.P., and Jackson, M.L. 1960. Iron oxides removal from soils and clays by a dithionite–citrate system buffered with sodium bicarbonate. Clays and Clay Minerals, 7,
317–327. https://doi.org/10.1016/B978-0-08-009235-5.50026-7
Schwertmann, U. 1964. Differenzierung der eisenoxide des bodens durch extraktion mit ammoniumoxalat‐Lösung. Zeitschrift für Pflanzenernährung, Düngung, Bodenkunde, 105(3), 194-202. https://doi.org/10.1002/jpln.3591050303 (這篇是德文的,就不用特別去找了)